最全备案——这些间充质干细胞进展你应该了解!
最新数据,截至2020年11月,中国医药生物技术协会又公布了13个通过备案的干细胞临床研究项目(我国干细胞临床研究备案项目已经近100例,详情见附表),其中近80%使用的是间充质干细胞。

图片来源于网络,侵删
间充质干细胞由于其自我更新与多向分化潜能,近年来成为了医学重点攻关的对象。这一方向的研究,奠定了间充质干细胞在难治性疾病治疗中重要地位,现如今,间充质干细胞针对各种适应症的临床研究越来越多。
研究进展
国际进展
根据ClinicalTrials的最新数据,以“stem cells”为关键词搜索,全球目前有8259例临床研究,其中已完成3303项,主要完成疾病种类包括自身免疫性疾病、卵巢早衰、新冠肺炎、性功能障碍、心脑血管疾病、糖尿病、膝骨关节炎等。
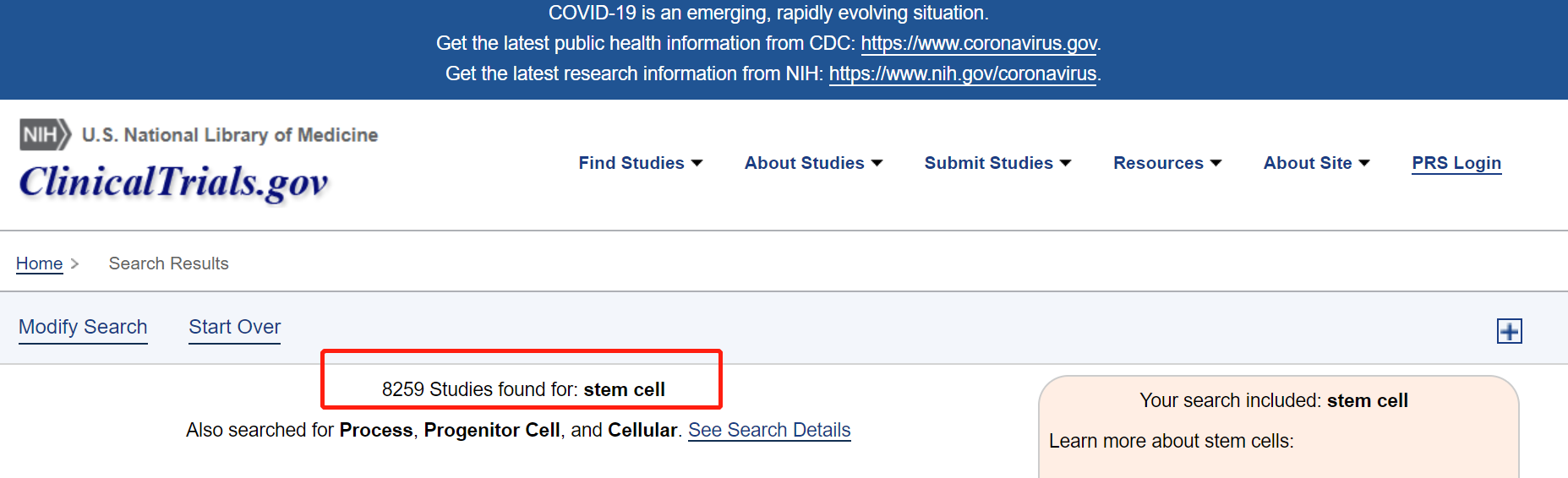
图片来源:ClinicalTrials
国内进展
据国家药监局药品审评中心(CDE)官网信息,2018 年 6 月至今,国内已经有 9 款干细胞新药 IND 获得临床默示许可,分别是胎盘、脐带、异体 / 自体脂肪来源的间充质干细胞,适应症分别为脑卒中、急性肠炎、类风湿关节炎、糖尿病足溃疡、膝骨关节炎和类风湿关节炎。
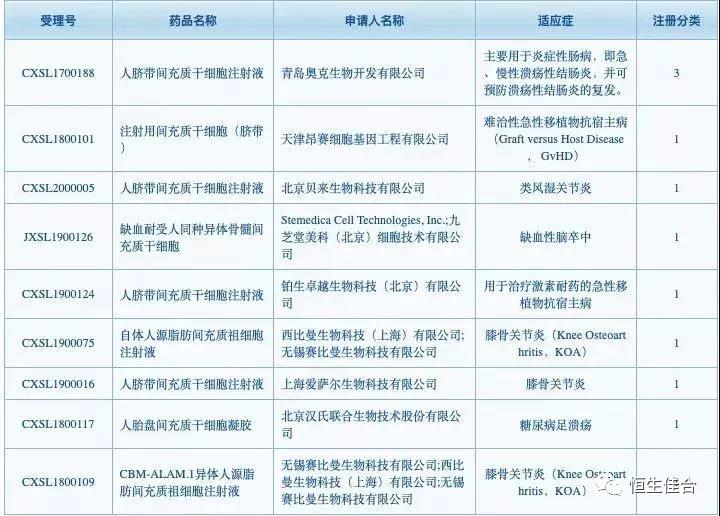
图片来源:国家药监局药品审评中心
政策盘点
【2020年8月 CDE】
国家药品监督管理局药品审评中心组织起草了《人源性干细胞及其衍生细胞治疗产品临床试验技术指导原则(征求意见稿)》,以期为药品研发注册申请人及开展药物临床试验的研究者提供更具针对性的建议和指南。
【2020年4月 国家药监局】
国家药监局关于发布《药品生产质量管理规范(2010年修订)》生物制品附录修订稿的公告。

此前,在2018年国家知识产权局发布《知识产权重点支持产业目录(2018年本)》,就将干细胞与再生医学、免疫治疗、细胞治疗等明确列为国家重点发展和亟需知识产权支持的重点产业之一。


迄今为止“干细胞及转化研究”已获得了五次中央财政经费支持。
2016年,25个拟立项项目(包含青年科学家项目)获得了约4.88亿元的经费支持;
2017年,43个拟立项项目又再获9.4亿元的经费支持。
2018年度发表于中国生物技术发展中心的“干细胞及转化研究”重点专项拟立项项目共计30个,总经费5.85亿元,项目周期均为2018-2022年。

另据2018年8月21日科技部公布的《“ 干细胞及转化研究” 试点专项2019 年度项目申报指南( 征求意见稿)》显示,2019年,中央财政将再拨款4个亿给予支持!

今年2020年3月科技部发布了《科技部关于发布国家重点研发计划“干细胞及转化研究”等重点专项2020年度项目申报指南的通知》。2020年,国拨总经费 2.40亿元。
研究进展
“用最科学的方法,使自己的身体变得更强大。”干细胞疗法不论针对患者、科研人员,还是用来改变当前医疗行业现状而言无疑都是很好的选择。从发展历程来看,干细胞对于难治性疾病治疗、再生医学领域,美容保健领域等给我们创造了很多奇迹,为患者和更多的家庭带来了新的希望;从发展趋势来看,未来的5~10年里干细胞行业将会有更大的进展。
附:干细胞临床研究备案项目汇总
2020年11月,广东省人民医院等十二家医疗机构的13个干细胞临床研究项目按照《干细胞临床研究管理办法(试行)》(国卫科教发〔2015〕48号)的规定完成备案。
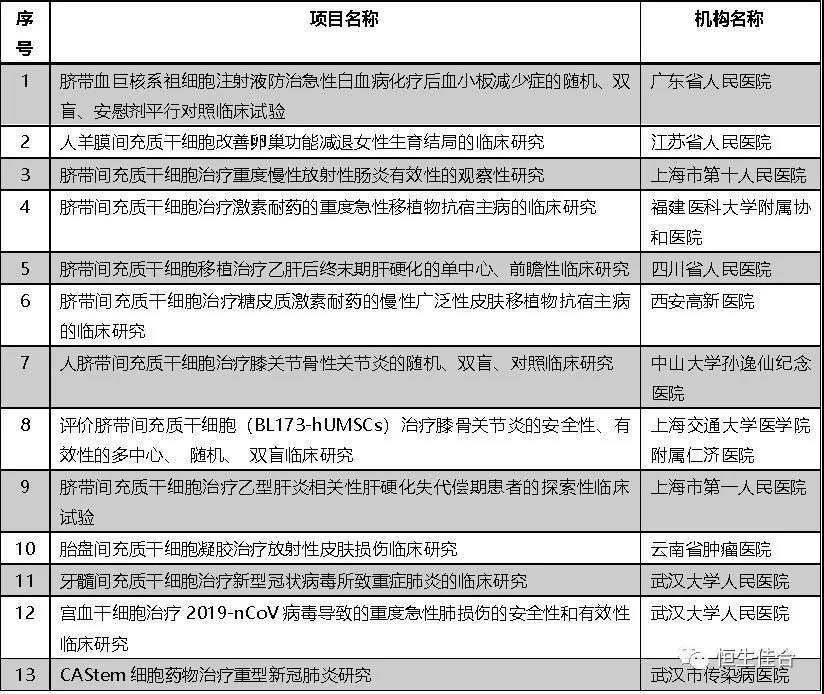
截止2020年3月19日浙江大学医学院附属第一医院等五家医疗机构四个项目先后在国家两委局完成备案。
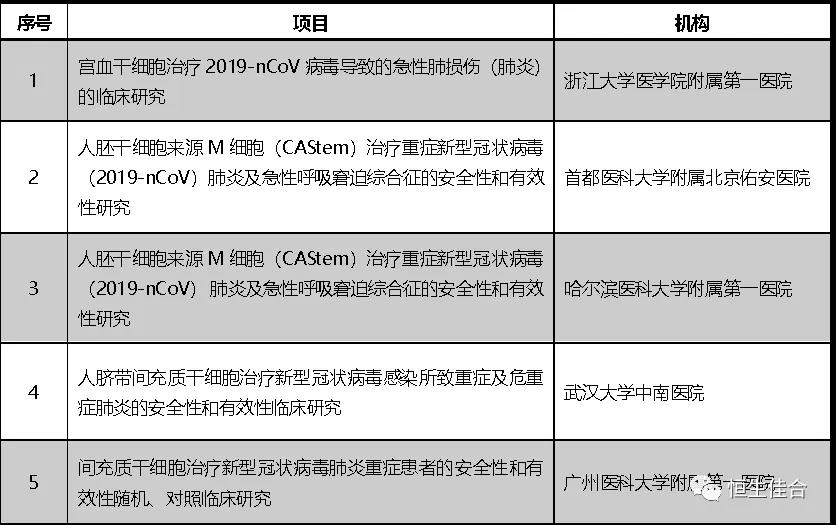
2019年12月,按照《干细胞临床研究管理办法(试行)》(国卫科教发〔2015〕48号)的规定,以及《关于做好2019年干细胞临床研究监督管理工作的通知》(国卫办科教函〔2019〕169号)文件精神,7个干细胞临床研究项目符合备案要求完成备案。
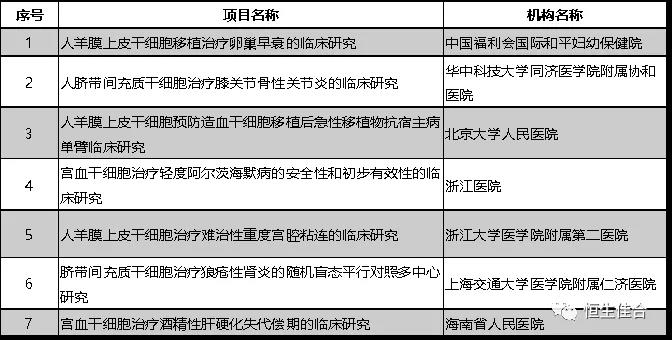
2019年9月,按照《干细胞临床研究管理办法(试行)》(国卫科教发〔2015〕48号)的规定,以及《关于做好2019年干细胞临床研究监督管理工作的通知》(国卫办科教函〔2019〕169号)文件精神,又有11个干细胞临床研究项目完成备案。
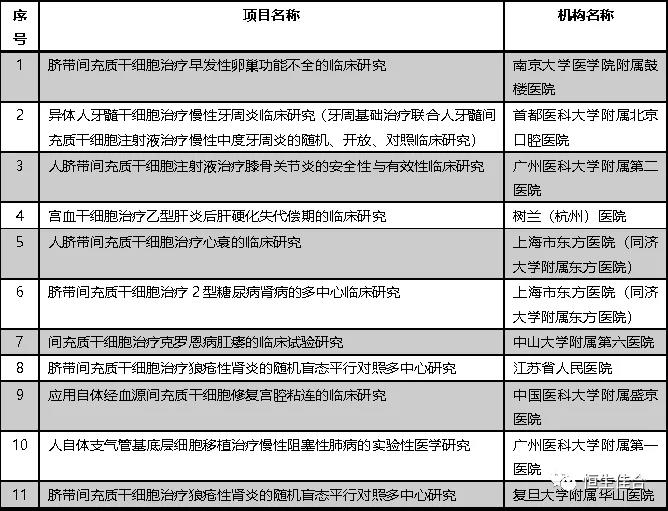
2019年6月,按照《干细胞临床研究管理办法(试行)》(国卫科教发〔2015〕48号)的规定,以及《关于做好2019年干细胞临床研究监督管理工作的通知》(国卫办科教函〔2019〕169号)文件精神,又有15个干细胞临床研究项目完成备案。
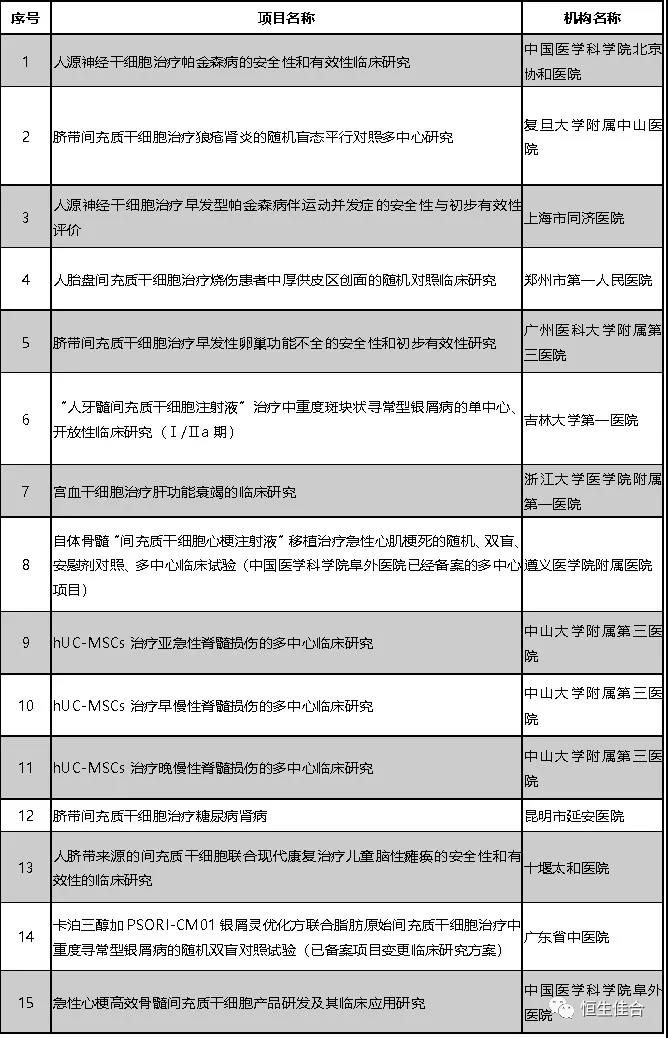
2019年3月,按照《干细胞临床研究管理办法(试行)》(国卫科教发〔2015〕48号)的规定,上海交通大学医学院附属仁济医院、青岛大学附属医院的2个干细胞临床研究项目完成备案。兰州大学第一医院申报的干细胞临床研究机构和项目同时完成备案。

2019年1月,安徽省立医院等8个干细胞临床研究项目按照《干细胞临床研究管理办法(试行)》(国卫科教发〔2015〕48号)的规定完成备案。
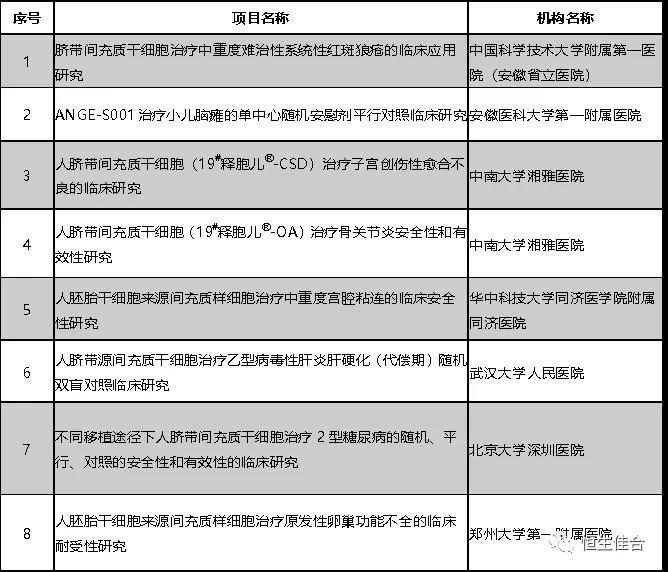
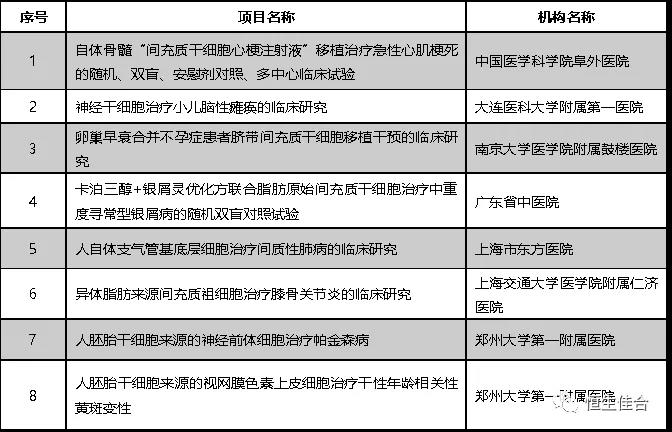
截至2018年9月,继第二批十家机构的12个干细胞临床研究项目备案之后,又7个干细胞临床研究项目按照《干细胞临床研究管理办法(试行)》(国卫科教发〔2015〕48号)的规定完成备案。
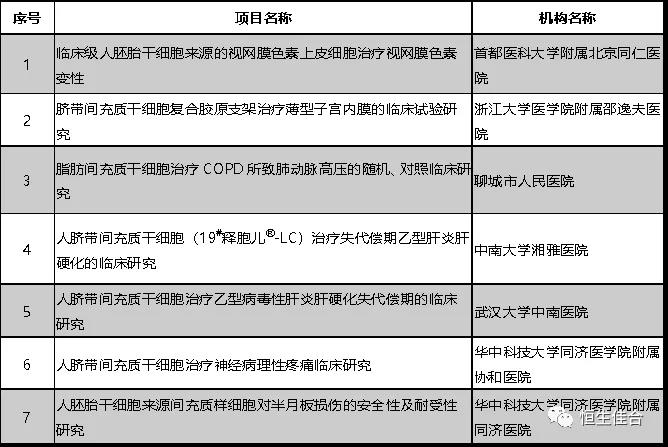
截至2018年5月,继第一批七家机构的8个干细胞临床研究项目备案之后,又12个干细胞临床研究项目按照《干细胞临床研究管理办法(试行)》(国卫科教发〔2015〕48号)的规定完成备案。
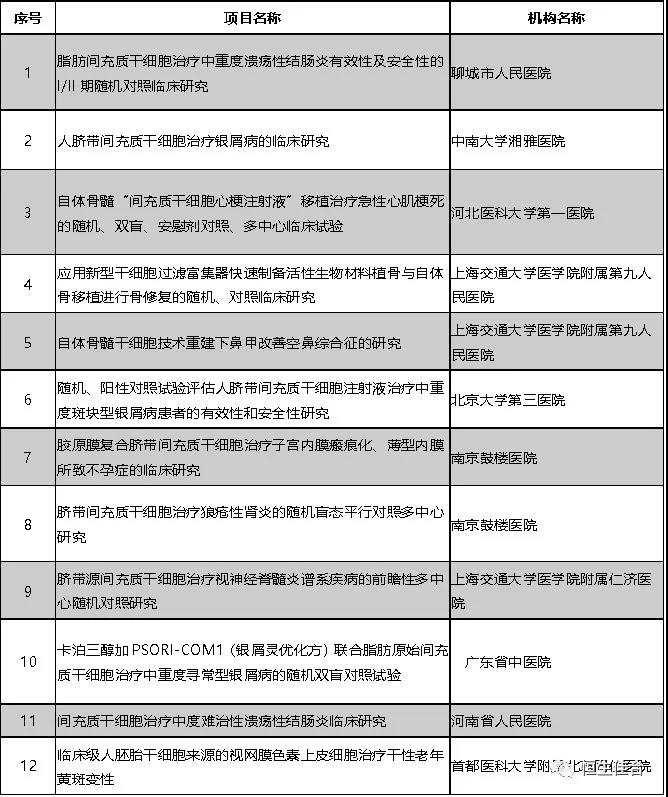
按照《干细胞临床研究管理办法(试行)》(国卫科教发【2015】48号)的规定,8个干细胞临床研究项目完成备案,并已按规定在医学研究登记备案信息系统登记,研究的摘要信息可以在系统查询。